[Small silencing RNAs & CRISPR-Cas systems]

今天我要跟大家介紹的是Small silencing RNAs跟CRISPR-Cas systems。

第一部分是討論Small silencing RNAs,以及跟他有關的三個調控基因沉默的途徑。接著第二部分,我會介紹跟基因剪輯有關的CRISPR cas systems。

在進入主題之前,先簡單介紹幾個基礎觀念。我們都知道細胞要製造蛋白質,一開始是要把DNA上的遺傳密碼轉錄為互補的mRNA,可是剛轉錄出來的mRNA是pre-mRNA,他還需要做進一步的修飾才會成為成熟的mRNA,在成為成熟的mRNA之後,他就會被帶出核膜外與核醣體結合,然後再藉由tRNA的協助進一步轉譯出蛋白質。這就是DNA生成蛋白質的基本過程。

在近幾十年來的研究中,研究的進展主要是來自於DNA和蛋白質,他們在科學家的研究中被認為是主角,那是因為DNA主要成分是A、T、C、G,而這些不僅是組成生物基本藍圖的要素,它們也提供了製造蛋白質的密碼,因此關於DNA和蛋白質的研究非常多,像是DNA,有研究者就利用DNA片段來進行基因療法,在治療血友病和遺傳性失明上都有顯著的作用。而蛋白質所引領的醫療發展,比較著名的就是人工合成胰島素、干擾素還有一些抗癌藥物等等。那為何RNA在醫療進展過程的研究中相對少呢? 一部分是因為RNA比起DNA還不穩定,他很容易被酵素分解,而且在過去,他也只是被認為是負責運送訊息、協調物資和維持細胞清潔的角色而已,所以常常被忽略。但是在近幾年,20世紀末的時候,有科學家發現RNA對於DNA和蛋白質的調控有驚人的表現,他們相信藉由操控RNA可以發展出癌症、傳染病和許多慢性疾病的新療法,那這也就是我們今天要介紹的主軸,看看RNA究竟有甚麼樣的功用,對於未來的醫療發展又有甚麼樣的潛力存在。

這是RNA的分類表,mRNA是我們最熟悉的,它帶有遺傳密碼,另外還有一大類是non coding RNA。像是rRNA、tRNA、snRNA、snoRNA、RNAi以及其他難以歸類的RNA。rRNA和tRNA我們都很了解了,snRNA是核小RNA,他會切掉pre-mRNA或是自己的intron來修飾RNA,那Sno RNA是小核仁RNA,它主要是協助RNA上核甘酸的修飾,因此這兩個都是負責修飾RNA的。如果是要調控RNA的話,主要就是能引發RNA干擾的miRNA(微RNA)和siRNA(小干擾RNA)這兩種。它們透過與mRNA或DNA上的基因片段,部分互補的方式,來調控基因表現。舉例來說,miRNA與酵素複合體會切碎mRNA,阻止mRNA被轉譯,或是加速mRNA的降解。至於siRNA,他通常是透過分解病毒RNA而得到的,然而也有一部分是內源性的siRNA,而他引發RNA干擾的機制跟miRNA很像,有些miRNA和siRNA,能造成目標基因的甲基化,進而促進或是抑制那個基因的轉錄。這部分比較細部的調控途徑我會在之後的ppt慢慢講。另外,還有這張表沒有提到的piRNA,因為我等一下也會介紹到他,所以我在這邊就稍微提一下,piRNA是在動物生殖細胞中發現的,他會跟一個叫piwi的蛋白結合形成piRNA複合物,他的途徑等一下會介紹.總而言之他也被認為跟RNA silencing有關。

接著進入PART 1, Small silencing RNA ,中文是沉默RNA。

那甚麼是沉默RNA呢?這裡有一個term叫做RNA interference ,就是RNA干擾.他是由雙股RNA所誘發的基因沉默現象,他的機制是透過去阻礙特定基因的轉譯或轉錄來抑制基因的表達。你們可以看上面這張圖,當細胞中導入與內源性mRNA編碼區同源的雙鏈RNA的時候,這個mRNA就會跟他結合然後發生降解進而導致基因表達沉默。這裡雖然寫siRNA,但其實還有其他種RNA也會透過其他種途徑造成基因沉默的現象。

除了siRNA,在後轉錄基因沉默現象中,還有miRNA和piRNA這兩個重要的途徑,接下來就要一個一個介紹了。

首先是siRNA,siRNA的全名是Small interfering RNAs ,他是一個短小干擾RNA分子,顧名思義就是會有破壞mRNA的現象。而他有多短小呢?他的長度只有21-25 個 核甘酸那麼短而已,他的主要參與過程是:siRNA的序列會和要被破壞的mRNA互補,接著siRNA會跟某一個蛋白質複合體結合,結合之後,就會在siRNA指定的位置上進行切割,也就是讓他degradation。

在siRNA的途徑中,有兩個重要的步驟,Step 1 跟 step 2。
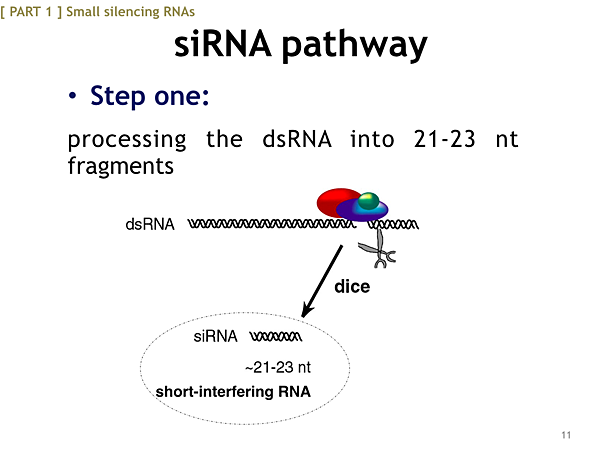
第一個步驟是,在RNA干擾的作用中,比較長的雙股RNA也就是dsRNA,他會進到細胞然後被Dicer這把剪刀切成比較小片段的siRNA,那麼究竟這把剪刀是甚麼呢?

它就是Dicer,他是一種核糖核酸內切酶,它屬於Rnase III 家族中有特異辨識雙鏈RNA的一個成員。他能將外源導入或者是病毒感染等等各種方式所引入的dsRNA切成siRNA,那麼經dicer作用後的siRNA結構長甚麼樣子呢?

他的結構通常是一段長21個核苷酸的雙股RNA,而兩股分別在RNA的兩端都超出另一端2個核苷酸的長度,然後每一股各有一個5'磷酸基末端與一個3'羥基末端。這就是經dicer切出的siRNA結構。

在切下來之後,第二步就是,siRNA會與一個複合體共同作用並接上mRNA,然後由這個複合體從antisense對應的mRNA序列中間切斷。那這個複合體是甚麼呢?

這個複合體就是一個,siRNA與一些蛋白質共同組成的RNA誘導沉默複合體,也就是RISC。先前被dicer那把剪刀切割下來的siRNA是雙鏈結構的,其中一鏈稱為anti-sense strand,另一鏈稱為sense strand。但隨後他會解旋成單鏈,而與核酶複合物形成RISC的那一股是anti-sense strand。
然後被啟動的RISC,就可以藉由鹼基配對定位到同源mRNA的轉錄序列上,然後在siRNA 3‘端12個鹼基的地方切割mRNA,讓他喪失轉錄的訊息,進而達到抑制目標基因表達的效果,以上就是siRNA 途徑中最主要的兩個步驟 。

接著介紹miRNA,miRNA是微RNA,英文全名是microRNA,他是一種內生性的單股、非編碼的小片段 RNA,長度約 21-22 個核苷酸,這些RNA會從primary transcript,也就是pri-miRNA,轉變成為這個pre-miRNA的stem-loop結構,但是它還只是miRNA的前體而已,他還需要在經過dicer的切割才能變成具有功能的miRNA。

miRNA的途徑可以用這張圖呈現,miRNA的作用機制和siRNA的機制很像。一樣都可以分為兩個階段:首先,先由基因組中轉錄出pre-miRNA,接著在microprocessor complex中,pre-miRNA切割成一個髮夾狀的pre-miRNA,在microprocessor complex中有RNase III家族的Drosha,它是一種切割酵素;另外還有Pasha,但他在這圖中沒有顯示,不過老師提供的參考文獻有提到,它們都是雙股RNA 的binding protein,接下來,切割成髮夾狀的pre-miRNA就會被Exportin-5由細胞核運到細胞質中。 接著,Dicer就能以ATP dependent的方式切割pre-miRNA,讓他成為20~22個鹼基的miRNA duplex。而後,他就會被分解成兩個單鏈的miRNA,但只有其中一鏈會成為mature miRNA,他會和一群蛋白質,主要成分為Ago2,形成RISC。
RISC就會和標靶mRNA結合,最後讓他分解或是讓他無法轉譯。

最後,我要介紹piRNA,piRNA的全名是Piwi-interacting RNA,他是最長的small non-coding RNA ,長度大約是29到30個核苷酸。他在許多動物的生殖腺中都有被發現,piRNA可以和Piwi蛋白結合形成piRNA複合物。我們先來看一下他的途徑......。

目前認為,piRNA途徑可能是保護生殖細胞基因組穩定性和完整性的一個通路,對於物種的遺傳很重要。然而因為他比較晚才被發現,所以現在的科學家對於他的代謝調控途徑還是不太了解。
上圖的文獻作者提到,pi RNA被認為是從單股RNA的前驅物延伸而來的,而且他不用經過dicing的步驟,也就是不用經過dicer那把剪刀的步驟,絕大部分的piRNA都是antisense,接著,當sense piRNA 跟AGO3作用的時候,Antisense piRNA會跟AUB或Piwi結合,接著HEN1就會在3’端進行甲基化,最後Piwi和AUB會跟AGO3結合進而產生額外的piRNA,然後Antisense piRNA很可能就會直接切斷transposon mRNA。由於文獻的內容內過深奧了,這只是我初步對他的認知。

接著第二部分,我要介紹CRISPR-Cas systems,在許多的原核生物中都具有CRISPR RNA,而他的作用機制就很像是真核生物中的RNA干擾。

CRISPR普遍存在於大多數的細菌和古細菌的DNA中,他被認為是細菌用來抵抗病毒感染的防禦機制,因為他可以辨認外來的DNA然後加以切割降解,在過去就我們高中所學,我們可能只知道細菌的防禦工具是限制酶,那是一個可以辨認DNA上的特定鹼基對序列然後將它切開的酵素。而…長大後我才逐漸了解,原來細菌還有第二套防禦機制,他就叫CRISPR(Clustered regularly interspaced short palindromic repeats),從字面上翻譯就是「群聚且有規律間隔的短迴文重複序列」。這是古細菌和細菌中的一種特殊序列,由24到48個鹼基對的重複序列組成的,重複序列間有很多個相鄰的間隔序列,就是上圖中的spacer,他可以用來辨識外來的核酸。另外,其中一部分基因編碼的蛋白是核酸酶和解旋酶,這些關聯蛋白又叫CAS, CRISPR-associated proteins。他與CRISPR共同組成了一整個CRISPR/CAS系統。

過去知道,細菌防禦噬菌體的主要方法是合成能夠分解外來DNA的限制性內切酶。但是現在發現,細菌還有另一個防禦系統,CRISPR/CAS,這一個系統厲害的地方就是他會利用抓取外來的這個核酸片段成為新的間隔序列,spacer,以保留它在過去曾經遇到過的病毒基因組片斷,進而讓它們能夠透過RNA干擾的方式來阻斷病毒的複製。也藉此增加了免疫的多樣性。這種遺傳系統為細菌提供了一個類似於獲得免疫的機制來對抗病毒的感染。所以它被認為是細菌的「後天免疫系統」。

那也因為發現CRISPR-Cas系統擁有這種基因編輯的特性,越來越多的科學家就透過他來擴展動物模型或是其他研究的應用。然而CRISPR/CAS他在近幾年那麼有名並不是因為他是唯一擁有基因編輯特性的系統,而是,他比起傳統的基因剪輯技術,像是鋅指核酸酶和 TALEN多了一些無可取代的優點,CRISPR/CAS的特點是他的效率很高、速度快、而且使用方式很簡單,因為過去使用的基因剔除技術,鋅指核酸酶和TALEN基因剔除工具,都必須經由繁雜的多步驟基因工程才能拼裝出能夠辨認目標序列的蛋白區位,然後才可以用來辨認並切割特定序列,但現在CRISPR-Cas系統,他是一個合成特定序列DNA或RNA的技術,所以比起拼裝重組蛋白還來的有效率一些,只需要幾天的時間就可以得到特定序列的產物,所以這就是CRISPR/Cas 轟動整個分生界的原因。因為他為研究帶來了更多的方便性與新契機。

這是CRISPR/Cas systems的主要流程,先是找一段感興趣的RNA序列片段,然後讓CRISPR/Cas系統結合上去,進行切割,而後在透過同源重组機制或非同源末端接合機制的方式進行修補。

這個CRISPR/Cas系統,目前已經發現有三種不同的類型 ,其中第二型的組成比較簡單,他是以Cas9蛋白和嚮導RNA,也就是gRNA為核心共同組成的。

這是三種 CRISPR /Cas系統類型對於降解 DNA 的過程,CRISPR 分為三種類型。第一型是透過 Cascade:crRNA複合體去辨識互補的 DNA ,然後再經由 Cas3 核酸酶進行 DNA的降解。而第三型跟第一型很像,一個包含 Csm 或 Cmr蛋白與 Cas6 蛋白的複合體會與 pre-crRNA結合。
在經過加工處理之後,pre-crRNA就會形成 crRNA ,最後透過這種複雜的複合體來辨識與分解互補的 DNA 序列。而第二型的 CRISPR/Cas9 系統並不需要產生一個複雜的蛋白複合體,他只需要透過 Cas9蛋白結合由 crRNA與 tracrRNA 形成的 pre-crRNA 就可以讓 RNase III 加工形成成熟的 crRNA ,進而讓 Cas9/ tracrRNA:crRNA 複合體可以去辨識與切割互補的 DNA 。由於第二型 的CRISPR 系統相較於其他兩種系統更為簡單而且方便,因此他就在 2013 年的時候被開發並且廣泛應用在各種不同物種的基因剔除研究中。

雖然第二型 CRISPR/Cas9 系統相較於其他兩類型來說,沒有複雜的蛋白複合體結構顯得簡單許多,但是他還是需要有 crRNA 與 tracrRNA 才能進行 DNA 的辨識,因此就有幾位科學家嘗試將 crRNA 與 tracrRNA 相接形成一個嵌合體,也就是圖中的sg RNA,他可以成功保留他對DNA 辨識與切割的活性,圖A呈現出原始的第二型 CRISPR 需要 crRNA和tracrRNA 複合體進行DNA辨識,圖B是將 crRNA 與 tracrRNA 連接形成 一個guide RNA ,也就是gRNA,他可以保留 Cas9 對於DNA 辨識與切割的能力。接著圖C是將gRNA加長,來增加他對基因剔除的效率。

第二型 CRISPR/Cas9 應用在基因工程上,主要是透過一個來自於化膿性鏈球菌 的 Cas9 蛋白與 gRNA來形成一個複合體。而這個複合體會與互補的 DNA 進行辨識,這裡有一個叫Protospacer 的東西,他位在gRNA 前端, 5’端的地方,他是辨識 DNA 序列最主要的方式,而緊接在他後面的是三個核苷酸序列 (NGG) ,他就叫做PAM, Protospacer adjacent motif ,主要是讓 Cas9 辨識並且切割 DNA。

在切割完DNA之後,所造成的雙股DNA斷裂,在過去傳統的方法是,會透過同源重组機制,針對斷點附近的基因序列進行序列置換,也就是HDR,但現在CRISPR之所以比起這些傳統方法更快速且有效率是因為它是利用非同源末端接合機制,就是NHEJ,來修復DNA的斷點。而這種方式很容易發生錯誤,也就是可能會有缺失或插入進而造成突變的狀況,那也正因為這樣子,就可以達到基因剔除的目的。

這是關於CRISPR/Cas 的小小總結,CRISPR造成DNA雙骨斷裂之後,他會透過非同源末端接合機制也就是NHEJ來做修復。

接著,這是CRISPR的應用,像是最簡單的Gene disruption 還有透過將一個報導基因的knock-in來剔除原本的特定基因,而第三個是可以做定點突變。

或是將Luciferase 螢光素酶去取代 5’端的exons ,例如將綠色螢光蛋白GFP基因置入目標基因的位置之後,就可以得到帶有螢光蛋白篩選標記的突變果蠅。然後最後是條件性的基因剔除。由此可見,伴隨著不同的實驗設計,Cas9的技術在未來的發展其實是無可限量的。

現在CRISPR/Cas9在人類細胞基因剔除上已經有一些顯著的成果,而透過他去對......像是杭丁頓舞蹈症、囊狀纖維化或鐮刀性紅血球貧血症等因少數基因的微小突變造成的這類嚴重遺傳疾病進行基因療法,是現在許多科學家正積極在做的。如果真的能夠成功治癒的話,那我想這會是醫療發展上的一個很大的福音。所以未來的遺傳學與生物醫學的研究,是相當值得去期待的。
Ref.
1. 科學人 RNA未來新趨勢, 2014
2. 科學人 基因剪輯魔術師 CRISPR, 2014
3. Prashant Mali, Kevin M Esvelt & George M Church. Cas9 as a versatile tool for engineering biology. Nature Mathods.
4. 高瞻自然教學平台
以上為我的不專業介紹,如有任何不當的內容歡迎隨時來信(b506100085@tmu.edu.tw)告知,謝謝。





 留言列表
留言列表

